La segunda ley de la termodinámica y la entropía; Clausius.
El 2 de enero de 1822, nacía el físico y matemático alemán Rudolf Julius Emmanuel Clausius (Koszalin, Prusia, 2 de enero de 1822- Bonn, 24 de agosto de 1888).
 Estudió en la Universidad de Berlin de 1840 a 1844. En 1848, se doctoró por la Universidad de Halle. Fue profesor de física en la Escuela Real de Artillería e Ingeniería de Berlín (1850-1855) y catedrático de física en las universidades de Zurich (1855-1867), Wurzburg (1867) y Bonn (1869), en la que permanecería hasta su fallecimiento.
Estudió en la Universidad de Berlin de 1840 a 1844. En 1848, se doctoró por la Universidad de Halle. Fue profesor de física en la Escuela Real de Artillería e Ingeniería de Berlín (1850-1855) y catedrático de física en las universidades de Zurich (1855-1867), Wurzburg (1867) y Bonn (1869), en la que permanecería hasta su fallecimiento.
Su artículo más famoso, «Über die bewegende Kraft der Wärme» («Sobre la fuerza motriz del calor y las Leyes del calor que pueden ser deducidas») se publicó en 1850 y se refería a la teoría mecánica del calor.
En este trabajo, demostró que existía una contradicción entre el principio de Carnot yel concepto de conservación de la energía. Clausius reiteró las dos leyes de la termodinámica para superar esta contradicción (la tercera ley de la termodinamica fue desarrollada por Walther Nernst entre los años 1906 y 1912).
«Es imposible que una máquina, sin ayuda mecánica externa, transfiera calor de un cuerpo a otro más caliente».
En 1851, Lord Kelvin ofrecería un nuevo enunciado:
«Es imposible construir un dispositivo que, utilizando un fluido inerte, pueda producir trabajo efectivo causado por el enfriamiento del cuerpo más frío de que se disponga».
Finalmente, en 1909, el enunciado más formal sería el del matemático Constantin Carathéodory:
«En cada vecindad arbitrariamente próxima a un estado inicial dado, existen estados a los que, mediante procesos adiabáticos, no se pueden acercar tanto como se quiera.»
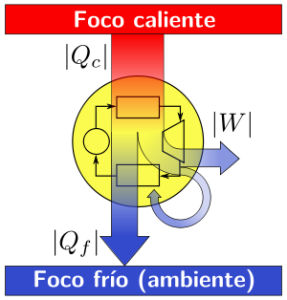 En sentido formal, el segundo principio de la termodinámica dictamina que la materia y la energía no se pueden crear ni destruir, sino que se transforman, y establece el sentido en el que se produce dicha transformación. Sin embargo, el punto capital del segundo principio es que, como ocurre con toda la teoría termodinámica, se refiere única y exclusivamente a estados de equilibrio. Toda definición, corolario o concepto que de él se extraiga sólo podrá aplicarse a estados de equilibrio, por lo que, formalmente, parámetros tales como la temperatura o la propia entropía quedarán definidos únicamente para estados de equilibrio
En sentido formal, el segundo principio de la termodinámica dictamina que la materia y la energía no se pueden crear ni destruir, sino que se transforman, y establece el sentido en el que se produce dicha transformación. Sin embargo, el punto capital del segundo principio es que, como ocurre con toda la teoría termodinámica, se refiere única y exclusivamente a estados de equilibrio. Toda definición, corolario o concepto que de él se extraiga sólo podrá aplicarse a estados de equilibrio, por lo que, formalmente, parámetros tales como la temperatura o la propia entropía quedarán definidos únicamente para estados de equilibrio
Clausius hizo una importante contribución en 1857 al campo de la teoría cinética redefiniendo el modelo cinético de los gases de August Krönig, mucho más simple, para incluir los movimientos de traslación, rotación y vibración de las moléculas. En este mismo trabajo introdujo el concepto de recorrido libre medio o camino libre medio de una partícula. En mecánica estadística y teoría cinética de los gases, se define como camino libre medio a la distancia o espacio entre dos colisiones sucesivas de las moléculas de un gas.
Clausius deduce la Relación de Clausius-Clapeyron de termodinámica. Esta relación, que es una manera de caracterizar la transición de fase entre dos estados de la materia, tales como sólido y líquido, había sido desarrollada originalmente en 1834 por Émile Clapeyron.
En termoquímica, la ecuación de Clausius-Clapeyron es una manera de caracterizar una transición de fase de primer orden que tiene lugar en un sistema monocomponente. En un diagrama P-T (presión-temperatura), la línea que separa ambos estados se conoce como curva de coexistencia. La relación de Clausius-Clapeyron determina la pendiente de dicha curva.
En 1865, Clausius primero dio una versión matemática del concepto de entropía definida como la proporción de energía de un sistema que no es capaz de desarrollar trabajo, y demostró que la entropía de un sistema se incrementa en un proceso irreversible. Clausius eligió la palabra «entropía», del griego entropein, que significa «contenido transformador» o «transformación de contenidos»(«Verwandlungsinhalt»).
 En termodinámica, la entropía (simbolizada como S) es una magnitud física que, mediante cálculo, permite determinar la parte de la energía que no puede utilizarse para producir trabajo. Es una función de estado de carácter extensivo y su valor, en un sistema aislado, crece en el transcurso de un proceso que se dé de forma natural. La entropía describe lo irreversible de los sistemas termodinámicos.
En termodinámica, la entropía (simbolizada como S) es una magnitud física que, mediante cálculo, permite determinar la parte de la energía que no puede utilizarse para producir trabajo. Es una función de estado de carácter extensivo y su valor, en un sistema aislado, crece en el transcurso de un proceso que se dé de forma natural. La entropía describe lo irreversible de los sistemas termodinámicos.
En los años 1890 – 1900 el físico austríaco Ludwig Boltzmann y otros desarrollaron las ideas de lo que hoy se conoce como mecánica estadística, teoría profundamente influenciada por el concepto de entropía. Una de las teorías termodinámicas estadísticas (la teoría de Maxwell-Boltzmann) establece la relación entre la entropía y la probabilidad termodinámica.
Entre las obras de Clausius, cabe citar La función potencial y el potencial (1864) y, de forma especial Teoría mecánica del calor (1876). El primer volumen de esta última obra desarrolla en fórmulas matemáticas los dos principios de la termodinámica.
Entre los numerosos honores que recibió a lo largo de su carrera, cabe destacar su elección como miembro de la Real Sociedad de Londres en 1868 y el haber sido galardonado en 1879 con la Medalla Copley.
El cráter Clausius en la Luna fue nombrado en su honor
Publicado el 2 enero, 2016 en Física, Matemáticas, Química. Añade a favoritos el enlace permanente. 1 comentario.

Hace mucho deseaba saber sobre este gran físico, Muchísimas gracias
Me gustaLe gusta a 1 persona